- HOME
- 公害防止管理者資格取得支援
- 2023年 1月
- 通信教育QA:3大気特論
通信教育QA:3大気特論
第1章 燃料
Lesson1 気体・液体・固体燃料
- LNGとLPGの発熱量について
-
- Q全文:LNGとLPGの発熱量について詳しく知りたい。
液化石油ガス(LPG)50.06 MJ/kg
液化天然ガス(LNG)54.48 MJ/kg
とされており、液化天然ガスの方が液化石油ガスよりも総発熱量が高くなっています。
ちなみに、ご質問中の数値を使い、LNGをメタン100%と仮定すると、単位質量当たりの発熱量は
39.8 MJ/m3N÷0.715 kg/m3N=55.7 MJ/kg
同様にLPGをプロパン100%と仮定すると、単位質量当たりの発熱量は
101.3 MJ/m3N÷1.966 kg/m3N=51.5 MJ/kg
となり、おおむね前述の発熱量の値となることが分かります。実際にはLNGもLPGも混合成分であり、産地による差異などはありますが、単位質量当たりの発熱量の大小は、LNG>LPGで間違っていないことが分かります。
発熱量では、「質量(1kg)当たりの発熱量は、気体でも液体・固体でも水素含有率が大きいものほど大きい」ということを覚えておくと有利です。
LNG(メタンCH4) 4/12≒0.33
LPG(プロパンC3H8) 8/36≒0.22
エタンC2H6 6/24=0.25
ブタンC4H10 10/48≒0.21 ※分子量 H:1 C:12
したがって、質量(1kg)当たりの発熱量の大小関係は、メタン>エタン>プロパン>ブタンとなります。また、気体燃料の体積(1m3N)当たりの発熱量は、(平均)分子量が大きいものほど大きくなります。したがって、ご質問のように、体積当たりの発熱量の大小関係は、プロパン(分子量44)>メタン(分子量16)となります。 - Q全文:LNGとLPGの発熱量について詳しく知りたい。
- コークス炉ガスと高炉ガスの違いについて?
-
- Q全文:コークス炉ガスと高炉ガスの特性の違いについて詳しく知りたい。
組成は種々の条件で異なりますが、一例では
CO2 (2.5%), CnHn (3.0%), O2 (0.7%), CO (9.9%), H2 (52.1%), CnH2n+2 (27.3%),
N2 (4.5%) 発熱量 5,000kcal/m3、メタンは CH4 で 上記の CnH2n+2 の一種です。このように燃えやすい物質(メタン、水素、一酸化炭素)を多く含むため発熱量が大きいガスです。
一方、“高炉ガス”は鉄の溶鉱炉から出るガスであり、溶鉱炉中のコークスが酸素不足の空気中で燃焼し、また鉄鉱石中の酸素及び多少の水蒸気と反応して発生するガスです。その組成の一例は、CO2 (12%), CO (27%), H2 (2%), N2 (60%) 発熱量は 700~1000kcal/m3 程度です。発熱量、理論空気量が小さいのは、高炉ガス中の可燃性ガス量が少ないので当然のことです。また、 (CO2)max値が大きいのは、高炉ガス中の可燃性ガスがCO2 と H2 のみであり、大部分が CO2 であること。また、すでに CO2 を多量に含んでいることによるものです。
- Q全文:コークス炉ガスと高炉ガスの特性の違いについて詳しく知りたい。
第2章 燃焼計算
Lesson2 燃焼計算の基礎
- 化学反応式における原子(数)、分子(数)について
-
- Q全文:化学反応式における原子(数)、分子(数)について詳しく知りたい。
例えば、2H2+ O2→2H2O(水素の燃焼)、C + 1/2 O2→CO(炭素の燃焼)の化学反応式を例に説明して下さい。
A答え:第1に化学、化学式の共通の約束を理解してください。
1 水などの物質の多くは『分子』と呼ばれる粒子の膨大な集合体と考えられています。
2 分子は極めて小さいため、どのような高性能電子顕微鏡を用いても見ることはできません。
3 分子は複数種類の『原子』が結合したもので、原子には水素(H)、炭素(C)、酸素(O)など百余種があります。ちなみに“水素”を元素名(原子の名称)、“H”を元素記号といいます。
4 例えば「水分子」は2個の水素原子と1つの酸素原子が「化学結合」したもので、『H2O』と表現します。これを「水の化学式」と呼んでいます。元素記号の後方(右側)に記してある小さな数字は、分子中に存在する前方(左側)の元素の個数を示しています。例えばH2Oの2は、分子に含まれる水素原子(H)が2つであることを示します。
5 これらの記述からわかるように、水分子「H2O」は図1から3のように考えられています。
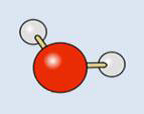
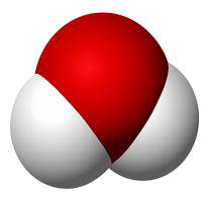
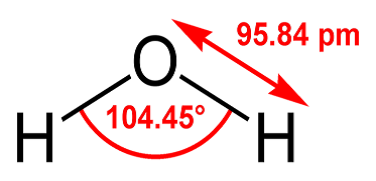
図1棒球図 図2 図3
図1は最もよく使用されるモデルで、原子は“球”、化学結合を“棒”で表示しています。本図では酸素原子を赤、水素原子を白い球で表します。図3は最もよく使用される分子の表記方法です。図中の赤字はO-H 結合とO-H 結合の角度(結合角という)およびO, H 原子の結合距離です。分子や原子は目で見ることができないにもかかわらず実験的に、このように詳細なところまで求められています。
6 もし、水分子が2つある場合は、『2H2O 』と記述します。分子の化学式の前側(左側)の数字は分子の個数を表します。
7 したがって、『2H2O 』は水分子が2分子ですから、図4 のようになります。
図からわかるように水素原子数= 4 酸素原子数= 2ということになります。

図4 2H2O
8 そこで、ご質問の2H2+ O2→2H2Oの反応ですが、
水素分子(ガス状)2分子と酸素分子(ガス状)1分子が反応して、水分子が2分子できる反応です。注意しなければならないのは水素原子と水素分子、酸素原子と酸素分子は全く異なるもので、水素分子は水素原子2つが化学結合したもの、酸素分子は酸素原子2つが化学結合したものです。したがって、ご質問の反応を図示すると図5のようになります。
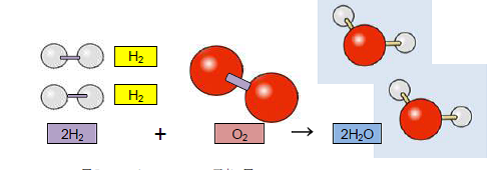
図52H2+O2→2H2O 反応の図
9 次にC + 1/2 O2→COは、炭素(C)と酸素(O2)の反応によって、一酸化炭素(CO)が生成する反応です。もう、これまでの説明でお分かりのように、1/2 O2はO ですからご質問の反応が成立します。
- Q全文:化学反応式における原子(数)、分子(数)について詳しく知りたい。
Lesson3 気体燃料の燃焼計算
- 乾き燃料ガス中の余剰空気に含まれる酸素の割合について
-
- Q全文:燃焼計算において乾き燃焼ガス中の余剰空に含まれる酸素の割合は21%として扱うがその理由について知りたい。
A答え:“乾き燃焼ガス中”の“余剰空気” とは実際に燃焼のために供給する“空気量” すなわち 所要空気量(A)と完全燃焼のために最低限必要な空気量、すなわち 理論空気量(A0)との差です。
したがって、余剰空気量 = 所要空気量 - 理論空気量 = A-A0
ところで A = m A0 m:空気比 ですから、
余剰空気量 = A-A0 = m A0 -A0 = ( m -1 ) A0
「所要空気」は燃料を完全燃焼させるために炉に送入する空気量。しかし、理論的に完全燃焼させるのであれば「理論空気量」があればよいのです。したがって、実際の燃焼で燃焼空気として所要空気量を送入した場合、
①理論空気中の酸素は全て燃料との燃焼反応で消費される。ちなみに、理論空気中の酸素濃度は21% ですが、すべて消費されるため、燃焼排ガス中の酸素量は 0 となります。
②所要空気量と理論空気量の差 すなわち余剰空気量は 炉内で燃料を完全燃焼させるために補助的に送り込んだ空気であり、通常は燃焼に全く関係せず燃焼排ガス中に出てくることになります。つまり、余剰空気だけを分離できるならば、それは余分に送り込んだ空気そのものなので、その中の酸素濃度は21% なのです。
- 燃焼ガス中のCO2等の濃度計算の際の窒素酸化物の扱いについて
-
- Q全文:気体燃料の燃焼計算として、「燃焼反応を純酸素で行う事は、反応速度が速い為極めて危険であり、通常の燃焼は空気中の酸素を使用する」とありますが、空気中には酸素以外に窒素等があり、燃焼ガスには窒素酸化物等のガスも存在する為、燃焼ガス中の二酸化炭素等の濃度を計算する時は、この窒素酸化物等を加味して計算する必要はないのでしょうか。
空気の成分は大雑把に言って、窒素(N2) 78%、酸素(O2) 21%、アルゴン(Ar) 0.9% です。これらの3成分のみで99.9% を占めます。3成分以外で最も多い成分は二酸化炭素(CO2) で、その量は約 0.04%(400ppm)、CO2以外の成分はさらに 2桁程度少なく、その多くは不活性ガスと呼ばれるものです。
一般に燃焼によって発生するCO2 は、湿り排ガス中でも数~数十%になりますから燃焼空気中のCO2が、燃焼によって発生するCO2濃度等に影響することはありませんし、考える必要もありません。
窒素酸化物についても同様で、空気中での窒素酸化物濃度は 1/100ppm 程度以下、燃焼で発生する窒素酸化物は温度にもよりますが、だいたい 100ppm のオーダーですからこれも測定値が影響を受けることはありません。
これらの状況から、燃焼用の空気は窒素 79%(窒素とアルゴンには類似点がある)、酸素 21% として計算を行います。 - Q全文:気体燃料の燃焼計算として、「燃焼反応を純酸素で行う事は、反応速度が速い為極めて危険であり、通常の燃焼は空気中の酸素を使用する」とありますが、空気中には酸素以外に窒素等があり、燃焼ガスには窒素酸化物等のガスも存在する為、燃焼ガス中の二酸化炭素等の濃度を計算する時は、この窒素酸化物等を加味して計算する必要はないのでしょうか。
Lesson4 液体・固体燃料の燃焼計算
- 乾き燃焼ガス量計算の際の水蒸気の取り扱いについて
-
- Q全文:乾き燃焼ガス量については
G’ = mA0 -5.6h + 0.7o + 0.8n (m3/kg)
で求められるとしていますが湿り燃焼ガス量を求める式
G’ = mA0 +5.6h + 0.7o + 0.8n+1.244w (m3/kg)
より発生した水蒸気を重複して除いた値にはならないのでしょうか?
A答え:G’ = mA0 +5.6h + 0.7o + 0.8n+1.244w (m3/kg)は、「燃焼反応前後の体積変化に着目して」湿り燃焼ガス量を算出する方法です。このため、湿り燃焼ガスの「組成」すなわち、例えば水蒸気の量は、水蒸気の「発生量」ではなく、水素の燃焼によって燃焼ガス中で生じる「体積増加量」が示されています。
①を実例で示します。
燃料中の水素の燃焼の燃焼方程式は
2H + 1/2 O2 → H2O ----------------- (1)
となります。これは、水素 2kmol(2 kg)と酸素ガス(O2)1/2 kmol が反応して水蒸気 1 kmol が発生することを示しています。
これを水素 1 kmol(1 kg)あたりに換算した表が下表です。
物質名
kmol
質量 (kg)
体積 (m3)
発生・消費
水素
1
1
0
---
酸素(ガス)
1/4
8
5.6
消費
水(水蒸気)
1/2
9
11.2
発生
したがって、水素1kmol (1kg) が燃焼すると、酸素 5.6m3 が消費され、11.2m3 の水蒸気が発生します。このため、燃焼ガスの体積増加は 11.2 – 5.6 = 5.6 m3 ということになります。水蒸気の発生量は 11.2 m3 ですが、水素の燃焼のために 5.6 m3 の酸素が使用されたのです。
もちろん、h kg の水素の燃焼では、上記の数値に h を乗じた値例えば 5.6 hm3になります。湿り排ガスと乾き排ガスの相違点は、乾き排ガスでは湿り排ガスでは考慮していた水蒸気を無視する点です。すなわち湿り排ガス量を表す
G’ = mA0 +5.6h + 0.7o + 0.8n+1.244w (m3/kg)
から水蒸気の発生量 11.2 h m3 を無視(差し引く)することによって、乾き排ガス量を表す
G’ = mA0 -5.6h + 0.7o + 0.8n (m3/kg)
式となります。ご質問で誤解があると考えられる点は、Q にまとめた文章中の下線付き太字部分です。すなわち、「5.6h は水素の燃焼により増加した体積で、全て水蒸気で」すが、決して水蒸気の発生量ではないのです。
- Q全文:乾き燃焼ガス量については
第3章 燃焼方法及び燃焼装置
Lesson5 燃焼管理
- 燃焼室熱負荷の定義について
-
- Q全文:火格子熱負荷とは燃焼室熱負荷を火格子の面積で割ったものという事は分りました。しかし、燃焼室熱負荷の定義が良く分りません。詳しく説明してほしい。
A答え:火格子燃焼ですから、通常石炭のような固体燃料で考えます。火格子面積とは石炭を燃焼させるための火格子の大きさで、石炭ストーブに例えるならばストーブ内の石炭が燃える格子の面積で、この火格子の下から燃焼に必要な空気が供給されます。
炉は燃焼室容積(すなわち炉の大きさ)が大きければ、炉内で大きな熱量が発生しても問題を生じませんが、小さい炉内で大量の熱量を発生させると炉の破壊などの大きな問題が生じることになります。一般に発生熱量の大きさは炉内での燃料の燃焼量に関係し、燃焼燃料量が多ければ多いほど発生熱量が多くなってきます。テキスト69ページの (5-1) 式の分子第1項は燃料の低発熱量、第2項は燃焼のために炉内に供給される空気による熱量。これらに燃料消費量を乗じたもの、すなわち(5-1) 式の分子全体で燃焼による発熱量を表しています。これを燃焼室容積(炉容積)で除するので、炉の容積当たりの熱量ということになります。
通常の燃焼炉では火格子面積の大きさと炉の大きさには一定の関係があります。したがって、通常の場合、火格子面積が大きくなれば炉の大きさも大きくなり、炉内で大きな熱量を発生させることができます。すなわち、多くの燃料を燃焼させることができますが、火格子面積が小さい場合には、一般に多くの燃料を燃焼させることができず、不完全燃焼になったり、無理に熱負荷を大きくすると炉の破壊など事故につながることになります。前述の石炭ストーブではストーブ内に無理やり多くの石炭を投入することに相当します。
- Q全文:火格子熱負荷とは燃焼室熱負荷を火格子の面積で割ったものという事は分りました。しかし、燃焼室熱負荷の定義が良く分りません。詳しく説明してほしい。
- 燃焼室熱負荷とは何か?また燃焼室の大きさとの関係について知りたい。
-
- Q全文:燃焼室熱負荷・火格子熱負荷が大きいと燃焼室を小さくすることができるとは、どういう意味でしょうか?
A答え:「燃焼室熱負荷」とは燃焼室(つまり炉のことです)にかけられる熱の量(つまり『熱負荷』)のことです。「燃焼室熱負荷」が大きいということはその炉が大きな熱量に耐えられるということです。 小さな燃焼室熱負荷の炉に大きな熱負荷をかけると、温度が上がりすぎて炉が壊れてしまうことになります。燃焼室熱負荷の単位は “W/m3” ですから、燃焼室 1m3あたりの熱負荷量(熱の量)です。
したがって、燃焼室熱負荷量の大きな燃焼室は、燃焼などで生じた、ある値の発生熱量を、小さな体積の燃焼室で処理できるまたは小さな燃焼室で済むということになります。
- Q全文:燃焼室熱負荷・火格子熱負荷が大きいと燃焼室を小さくすることができるとは、どういう意味でしょうか?
- 燃料使用範囲および油量調整範囲の定義について
-
- Q全文:燃料使用範囲と油量調整範囲の言葉の定義について詳しく知りたい。
A答え上表は様々な工場等で用いられているバーナーを①油圧式、②回転式、③高圧気流式、④低圧空気式に分類し、特徴を一覧表にしたものです。
項目 “燃料使用範囲”は各バーナーへのおおよその供給燃料量を表しています。もちろん同じ種類のバーナーであっても、メーカー、バーナーの新旧、要求される発熱量、使用燃料の種類や品質、バーナーが使用されている炉の規模、構造、断熱性等などによってその数値は大きく変わります。それらを含めたおおよその値であると解釈してください。例えば、油圧式バーナーは中小規模の炉では約50L/hの燃料で使用できますが、大規模な炉の場合5,000L/hという大量の燃料を燃焼することもできます。もちろん ”同じ方式” のバーナーであって、”同じバーナー” ではありません。一方、低圧空気式バーナーは燃料使用量が1.5L/h程度の小規模炉で所用することができますが最大でも燃料使用量は150L/h程度の中規模炉までで、大規模炉での使用には向いていないということを示しています。
項目 “油量調節範囲” はその名の通りバーナーに供給できる油量をどれくらいの範囲で調整できるかを示しています。これもメーカー等で大きく異なりますが、おおよその範囲と考えてください。基本となる量を“1”とします。基本となる量は通常最低の油供給量です。油圧式非戻り油形バーナーの油量調節範囲が “1:1.5~2” ということは、負荷が増加し大きな熱量を必要としても基本になる量の1.5~2倍程度にまでしか増やせない、ということを表しています。
- Q全文:燃料使用範囲と油量調整範囲の言葉の定義について詳しく知りたい。
Lesson6 ディーゼル機関等/すすの発生伝熱面の腐食/通風及び通風装置
- 燃焼ガス中に含まれる硫黄酸化物について
-
- Q全文:燃焼排ガス中の “SO2 は通常 0.2% 以下であり、その 1~5% が SO3 になる”は“燃焼排ガス中の SO3 濃度は(0.2×0.01 = 0.002)で、0.002%~0.01% 程度”になると理解してよいでしょうか。
また“重油燃焼ガスには 2~5% SO3 が含まれる”とありますが、重油燃焼では通常より SO3 が大きくなるということを説明していると理解してよいか、それとも、重油燃焼ガスの SO2 中に 2~5% の SO3 が含まれているということですか?
A答え:通常排ガス中の SO3 濃度は燃料、燃焼法等などによって変化します。しかし、その値は通常 10~数100ppm 程度であり、“2~5%”は多すぎます。したがって、ここは“重油燃焼ガスではSO2 含有量の 2~5%、微粉炭燃焼ガスでは1~2% SO3 が含まれる”と修正致します。
- Q全文:燃焼排ガス中の “SO2 は通常 0.2% 以下であり、その 1~5% が SO3 になる”は“燃焼排ガス中の SO3 濃度は(0.2×0.01 = 0.002)で、0.002%~0.01% 程度”になると理解してよいでしょうか。
- SO3と水蒸気が反応して生成される硫酸の性状は?
-
- Q全文:SO3 と水蒸気が反応して生成した H2SO4 はガス、液体のどちらでしょうか?
A答え:H2SO4 がガスであるか液体であるかは“温度”によります。すなわち、酸露点より高温であればガス状ですが、酸露点以下になると“液体”となり、装置の金属部分などを腐食する低温腐食を起こすのです。
- Q全文:SO3 と水蒸気が反応して生成した H2SO4 はガス、液体のどちらでしょうか?
Lesson7 燃焼管理用計測器
- 接触方式温度計と非接触方式温度計の特性と相違点について
-
- Q全文:接触方式温度計と非接触方式温度計の特性と相違点について詳しく知りたい
A答え:
温度を正確に測定することはここでわざわざ記述するまでもなく理論的にも現場での技術上でも極めて重要です。したがって、温度を測定する“温度計”は極めて基本的かつ重要な装置ということができます。
温度計にはテキストにも示したように“接触方式温度計”と“非接触方式温度計”があり(それぞれの方式には複数種類の温度計があります)温度を測定する場合には温度測定箇所、その箇所の状況によって多くの温度計の中から最適な温度計を選んで設置しなければなりません。このことからわかるように、接触方式温度計と非接触方式温度計の特徴を理解することは必要であり重要なことです。
接触方式温度計と非接触方式温度計とは全く異なる方式の温度計です。当然、① 測定精度、② 測定範囲、③ 測定できる場所等の制限 等が異なり、使用方法、使用箇所等も異なることになります。この点をまとめたのが 上表です。
すでに説明したように接触方式温度計と非接触方式温度計とは全く異なる方式の温度計ですから、ほとんどが両者の相違点になっています。接触方式温度計:温度計(温度測定素子)と温度測定箇所とを熱的によく接触させ、両者の温度が一致した時点(平衡状態になった時点)で測定を行います。測定素子を常に測定箇所と接触させておく必要があるので動く物体の温度を測定するのは困難な場合が多くなります。また、温度が平衡に達するまでの時間が遅れ時間になります。温度を測定する箇所の熱容量が小さい場合、測定素子の熱容量によって温度に影響が出ます。この時、測定素子の熱容量を小さくする(例えば、熱電温度計の測定素線を細くする)と測定温度への影響は小さくなりますが耐熱性が落ちるなどの問題が生じます。
非接触方式温度計:発熱体等が放射する赤外線等の強度を測定し、温度測定します。非接触なので移動する対象の測定も容易です。しかし、物体の表面温度しか測定できません。また、赤外線吸収物質の濃度が高いなどの場合、妨害を受けることがあります。
これらの特徴は温度計の種類選択に関して絶対に理解すべき事項で、重要です。最低でもp117 の上表については理解、暗記する必要があると思います。
- Q全文:接触方式温度計と非接触方式温度計の特性と相違点について詳しく知りたい
第4章 排煙脱硫
Lesson8 排煙脱硫質
- 石灰スラリー吸収法排煙脱硫装置での化学反応は?
-
- Q全文:石灰スラリー吸収法排煙脱硫装置の脱硫プロセスにおける科学反応は?
CaCO3 +SO2+1/2H2O →CaSO3・1/2 H2O + CO2
CaSO3・1/2H2O+1/2O2+3/2H2O → CaSO4・2H2O
石灰石(CaCO3)等を用いた吸収塔で亜硫酸カルシウム(CaSO3・ H2O)とし、それを酸化塔でpH4以下に調整した上で空気酸化させることで石こうスラリー(CaSO4・2H2O)を生成させます。 - Q全文:石灰スラリー吸収法排煙脱硫装置の脱硫プロセスにおける科学反応は?
第5章 窒素酸化物排出防止技術
Lesson9 窒素酸化物の生成機構/低NOX燃焼技術
- NOxの生成要因と抑制技術について
-
- Q全文:NOx石の生成要因とその抑制技術について詳しく知りたい
- Q全文:NOx石の生成要因とその抑制技術について詳しく知りたい
-
上図 には NOx の生成要因とその抑制原理、抑制方法とそれらの関係を示しています。NOx は発生原因が2種あり、これがNOx 削減技術を複雑、多彩なものにしています。すなわち、
燃料中の N が燃焼することによって発生するNOx -------- フューエル(燃料)NOx
燃焼空気中の N2 が高温で酸化されて発生するNOx ------- サーマル(熱)NOx
です。これが図中左から2,3 列目の網掛け部分です。最も左の列にはこれらのNOx 生成要因を示しています。図中左から4列目にはフューエルNOx、サーマルNOxの生成を抑制する基本的な考え方、すなわち“抑制原理”を示しています。フューエルNOx抑制には1)低窒素燃料使用、2)酸素濃度の低下 を生成抑制のための基本原理とし、サーマルNOx抑制には1)酸素濃度の低下、2)火炎温度の低下、3)滞留時間の短縮 を生成抑制のための基本原理としていることを示しています。図中最右列はNOx抑制の実現技術です。上側は燃料改善に関する技術、下側は燃焼改善に関する技術を示しています。
Lesson10 排煙脱硝技術/装置の構成と運転。維持管理
- リークアンモニアの定義について
-
- Q全文:リークアンモニアの定義について詳しく知りたい
4NO + 4NH3 + O2 → 4N2 + 6H2O
NO + NO2 + 2NH3 → 2N2 + 3H2O
です。いずれも窒素酸化物とアンモニアの量(モル比)は 1:1 の反応であることが分かります。したがって、燃焼で発生する窒素酸化物と等モル数のアンモニアを脱硝装置内で加えることになります。これで完全に反応するはずですが、燃焼のとき実際に炉内に送入する所用空気量が理論空気量よりもわずかに多いのと同じく多少多めのアンモニアを加えたりし、排気ガス中に還元剤のアンモニアが多少残留する場合があります。 これをリークアンモニアと呼びます。
- Q全文:リークアンモニアの定義について詳しく知りたい
第7章 測定技術汚濁機構
Lesson12 燃料試験方法
- インクリメントとは何か?
-
- Q全文:「インククリメント」とは何か、詳しく知りたい。
A答え:インクリメント(increment) :サンプルから抜き取られた1部分 ; 1回の操作で取り出した少量の試料サンプリングにおける “インクリメント” とは上記のような意味です。インクリメントはコンピュータのプログラミングでも使用されその場合は増加させるという意味です。
大量の石炭などの品質を調査する場合、固体は気体、液体とは異なり、均一でないため、試料を採取した場所によって分析値は大きく異なってきます。これでは信頼性がないため、通常は以下のように行います。(大量の石炭の場合を例として示します。)
1.少量の試料を石炭の山の多くの個所から採取します。この少量の試料の一つ一つが “インクリメント” です。
2.インクリメントの採取は、石炭の山の表面だけでなく内部などなるべく多くを採取します。
3.次に採取したインクリメントを集め、“大口試料” としたのち、粉砕するなどして均一化します。
4.上記操作を “縮分” といいます。
5.縮分した試料の一部を分析用試料とします。
- Q全文:「インククリメント」とは何か、詳しく知りたい。