- HOME
- 公害防止管理者資格取得支援
- 2023年 1月
- 通信教育QA:5大気有害物質特論
通信教育QA:5大気有害物質特論
第1章 有害物質の発生過程
Lesson1 有害物質の発生過程
- 焙焼について
-
- Q全文:焙焼について詳しく知りたい。
A答え:「鉱石から不要なものを取り除き、金属を抽出して地⾦を製造する工程」を『製錬』と言います。製錬には鉱石を取り出す⾦属の融点以上の温度に加熱し、金属を溶融状態で取り出す「乾式製錬法」と低温で行う「湿式精錬法」があります。
これに対し『焙焼』は、製錬の前に「鉱石を製錬しやすい形に加熱変成する予備処理」で、鉱⽯中の金属を加熱して化学的に変成させ、その後の製錬処理を行いやすくする⽬的で⾏われます。類語として『煆焼 (かしょう) 』がありますが、こちらは単なる熱分解であるのに対し、『焙焼』は、化学変化を伴う点が異なります。温度が髙ければ反応速度が速くなりますが、エネルギー的には不利なため、焙焼温度は、変成が起こる最低の温度で行うのが理想です。焙焼の例として、⾦属の硫化物・砒化物の形の鉱⽯を、溶融しない程度の温度で焼いてひ素・硫⻩などを酸化物とし、気化させて⾦属製錬しやすくします。このような処理を「酸化焙焼」といいます。この他、目的とする金属成分をどのような化合物にするかによって、硫酸塩焙焼、塩化焙焼、還元焙焼などがあります。
- カドミウムの工業的利用の具体例は?
-
- Q全文:カドミウムは、工業的にはどのような用途に利用されているのでしょうか? 具体例を教えてください。
A答え:カドミウムは、カドミウムイエロー(硫化カドミウム(CdS))として顔料に用いられているほか、中性子遮断ガラスなどの特殊ガラスやガラス製品の副原料としても利用されています。
●カドミウムイエロー
カドミウムイエローは美しい黄色顔料で、顔料とは「水や油に不溶の微粉体を、水や油に分散させたもの」です。通常、黄色のペンキや絵具等が代表的な使用例です。
●特殊ガラス
ガラスに大量のカドミウム塩を加えてガラス化したものは、中性子の減速効果(これを「中性子遮蔽効果」という)があるため、「中性子遮断ガラス」又は「中性子遮蔽ガラス」と呼ばれています。極めて特殊なガラスであるため、原子炉研究施設や中性子回折実験装置(分子構造の研究などに使用)などに使用されています。
第2章 有害物質の処理方式
Lesson2 ガス吸収及び吸収装置
- 分圧と平衡の概念と両者の関係について
-
- Q全文:分圧と平衡の概念と両者の関係について詳しく教えてください。
A答え:分圧とは気体に関する “濃度”です。気体はどんな気体であっても標準状態(0℃,1気圧)において1mol=22.4Lです。したがって、排ガス中等における特定成分の存在割合(すなわち濃度)を示すには、全圧力に対する特定成分の圧力すなわち“分圧”で表示するのが最も簡単なのです。分圧は温度、圧力を一定とした場合の 体積/体積 比または分率ということもできます。
気体の濃度として分圧を使用するのは、①どんな特定成分であってもよいこと、②どのような外的条件(温度や圧力)であっても使用できることなどによります。
平衡: 平衡とは天秤やシーソーなどで左右のバランスがとれた状態をいいます。これが拡張され熱平衡、化学平衡などについても単に平衡という言葉で表されます。化学平衡と熱平衡では概念が多少異なります。
化学平衡:Aという物質が反応してBという物質ができる反応において、Aを原系(または反応系)、Bを生成系と呼びます。これをA→Bと表します。化学反応では特別なことがない限りA→Bと同時にA←Bという反応も起きており、A←B反応を“逆反応”と呼びます。また、逆反応が存在する反応を“可逆反応”といいます。
反応の速さ(反応速度)は反応する物質の濃度に比例します。したがって、反応A→Bが可逆反応である場合、
① 反応スタート時点ではA の濃度は高く、Bの濃度は0ですから、反応は一方的に右方向に進みます。スタート時点でB 濃度は0ですから、左方向反応(逆反応)は起きません。
② 右反応が進むと反応によってA濃度は減少し、B濃度が増加します。このため、A→B反応は次第に遅くなり、A←B 反応が速くなってきます。
③ 更に反応が進むとやがてA→B反応とA←B反応の速さが同じになって、化学反応は進んでいるにもかかわらず、一見したところでは反応が停止したように見えます。
④ このように外見上、時間が経過しても反応の様子が変わらない状態を“化学平衡”または“平衡”状態といいます。
いまガス成分A(量は分圧で表します)が液体に吸収されてB(量は濃度で表します)に変わる反応をA→Bで表すことにします。反応が不可逆であるということはA→B反応だけが起こっておりA←B反応が起きないということになります。このため、A→B反応はAの分圧が0になるまで一方的に起こり、A が0すなわち分圧が0になった時点で反応停止ということになります。
逆に可逆反応の場合、必ずA←B(いったん液体に吸収された物質が気化していく)反応によって Aの分圧が0になることはなく、時間が経つとほぼ一定の分圧pを示すことになります。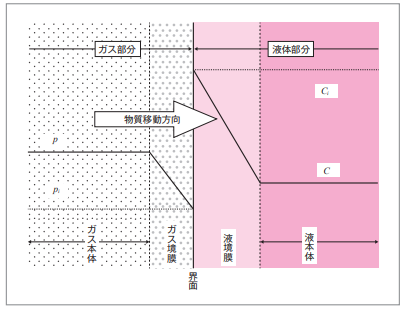
- ガス側抵抗・液側抵抗の定義
-
- Q全文:ガス側抵抗と液側抵抗の定義について知りたい。
A答え:ガス側抵抗、液側抵抗とは二重境膜のガス境膜、液境膜内における物質移動のしやすさと考えてください。
- ガス分散形吸収装置と液分散形吸収装置は何が違うのか?
-
- Q全文:ガス分散形吸収装置と液分散形吸収装置との違いがイメージできず、覚えられません。何が違うのでしょうか?
A答え:液分散形吸収装置は、被吸収ガスの中に、液(吸収液)を「スプレーによる噴霧」、「充填物の表面を流す」などの方法で噴霧し、吸収液の表面積を増大させ、被吸収ガスと接触させて、吸収液にガスを吸収(溶解)させる装置です。つまり、ガス分散形と液分散形は次のように要約できます。
吸収液の中にガスを噴霧し、被吸収ガスの表面積を増加させる → ガス分散形
ガスの中に吸収液を噴霧し、液の表面積を増加させる → 液分散形
一般に、被吸収ガスが吸収液に溶解しにくい場合、ガスの表面積をなるべく大きくして吸収液と反応させる方が反応性がよく、被吸収ガスが吸収液によく吸収されます。したがって、溶解度の小さなガスの場合、ガス分散形吸収装置が使用されます。
一方、液分散形吸収装置における液体と被吸収ガスの接触面積は、ガス分散形吸収装置の接触面積よりも小さくなります。そのため、液分散形吸収装置は溶解度の大きなガスの処理に使用されます。
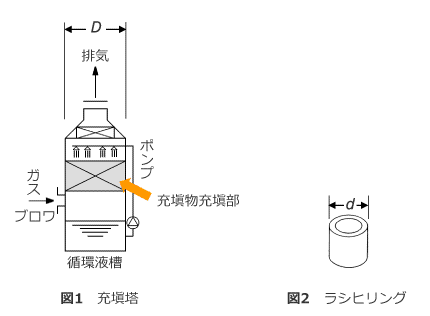
- 充填塔の塔径と充填物(ラシヒリング)の径との関係は?
-
- Q全文:充填物がラシヒリングの場合、充填塔の塔径とラシヒリング径との関係について教えてください。
ラシヒリングなどの充填物を充填する充填塔の直径、つまり「塔径」をDとします。ラシヒリングとは図2に示すような形をした充填物です。円筒形なので一般にサイズは直径で表わし、これをdとします。塔径に比べてラシヒリング径は1/10程度と小さく、通常、数百から数千個のラシヒリングが充填塔に充填されます。
A答え:液分散形吸収装置の一つである充填塔は、表面積の大きな充填物を詰めた塔内に上部から液を流し、ガスと向流に接触させて、ガス中の有害な成分を液体に吸収させる装置です。
塔径Dとラシヒリング径dとの関係は、dの値が小さいほど、すなわちD/dが大きいほど大量の充填物が充填されることになります。 D/d=10のとき液は比較的均一に流下しますが、D/d<10では液が塔壁に、D/d>10では液が塔中央部に集まる傾向にあることが認められています。
- 二重境膜説における抵抗支配について
-
- Q全文:二重境膜説におけるガス、液に抵抗支配について詳しく知りたい。
A答え:1.二重胸膜説の図の説明の前に図の背景(全体図)を理解してください。
2.雨が降った後、空気がきれいになったと感じることがありますが、これは雨滴に大気中のガス成分が“吸収”されたためと通常解釈されています。(もちろん大気中の粉じんなどが洗い落とされる効果もあります。)このようにガス中に水滴があるとガスの成分が水滴に溶け込んでいきます。これを図示すると図-1の右図のようになります。
3. ガス中の成分は、水滴とのガスの“界面”を通って水滴に溶解していきます。水滴とガスの界面部分(点線四角部分)を拡大したものが図-1 左図の“二重境膜モデル”ということになります。これを理解していただけばテキストの図2-1 が理解できると思います。
4. ガスと水滴の界面(接触面)では、ガス側と液体側にガス本体や液本体(水滴)とは性質が異なる“境膜”が形成されていると考えられています。ガス側が“ガス境膜”、液側が“液境膜”と呼ばれ、これが二重境膜モデルの名称の基になっています。
5. 境膜の性質についてはテキストP19 の“ガス吸収の理論”で詳細に説明していますが、ここで繰り返して説明します。① 界面の両側にできた“境膜”は薄い、② 境膜内では界面に対して直角方向の流れがない、③ このため境膜内の物質移動は分子拡散のみに依存する、④ したがって、境膜内の拡散は遅く物質移動の抵抗になる。
6. ガス側:縦軸は各位置における“分圧”を表します。分圧とは、被吸収物質の量を圧力で表示したものです。
① ガス中における“被吸収物質の量 = p”
② ガスと液体の界面では、液体にガスが溶解するため、ガスの分圧は pi に低下する
7. 液体側:縦軸は液体部の各点における、液体に溶解した“被吸着物質の濃度”を表します。ガス側の分圧とは直接の関係はありません。
① ガス側から被吸収物質が吸収されるため、被吸収物質濃度は最も高い濃度(Ci)となる.
② 被吸収物質濃度(Ci)は境膜を通して拡散し一定の濃度(C)となる。
8. 上の説明で分かるように、ガス側、液体側の両側でガス本体の被吸収物質分圧(p)、液体本体の被吸収物質濃度(C)と境界での被吸収物質分圧(pi)、被吸収物質濃度(Ci)には分圧差や濃度差が存在します。この“分圧差”や“濃度差”が境膜内での拡散、すなわち物質移動の推進力です。
9. “抵抗支配”に関して数式を全く使用せずに説明することは極めて困難です。数式を使用した説明はテキストの p19(3)ガス吸収の理論 ~ p20 (4) 抵抗支配 を参考にしてください。またこの部分の重要性は低いので、以下を暗記してください。
① 溶解度が大きいガスの場合:“ガス側抵抗が支配的”→ 液分散形吸収装置を使用
② 溶解度が小さいガスの場合:“液側抵抗が支配的”→ ガス分散形吸収装置を使用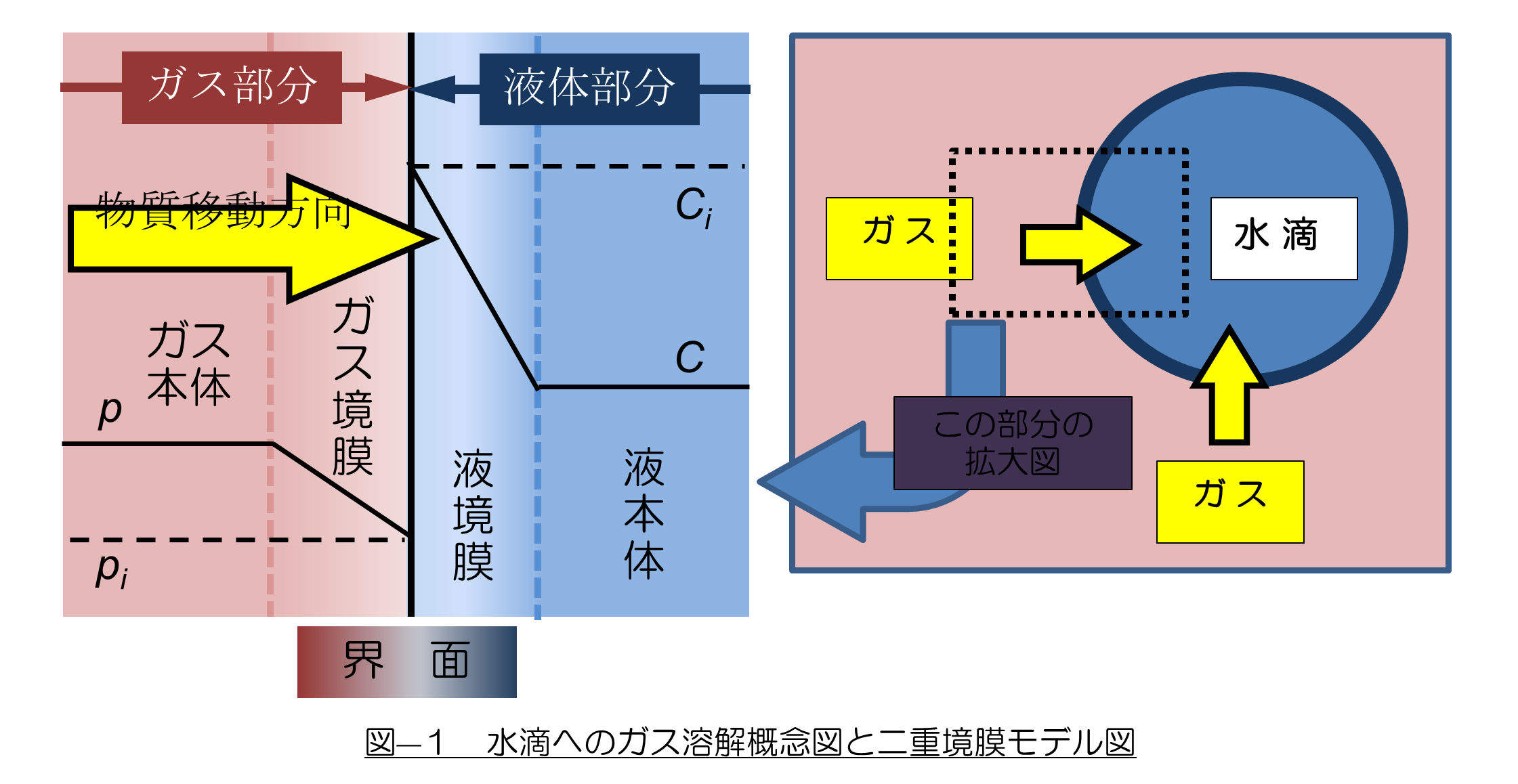
- ヘンリーの法則が成立する条件について
-
- Q全文:ヘンリーに法則はどのような条件下で成立するのか詳しく知りたい。
A答え:ヘンリーの法則は、気体分子を液体に溶かすとき、押し込む圧力が2倍になれば、溶ける気体分子の量も比例して2倍になる、ということを言っています。
この法則が成り立つ条件は、以下の2つの現象の平衡が成立する範囲において、かつ、気体分子が水と反応しない場合(物理吸収の場合)です。
(1)気体分子が水に溶ける現象
(2)水に溶けている気体分子が再び気相に飛び出す現象
水に溶けやすいガスの場合には、圧力を2倍、3倍と掛けるかどうかに関わらず大量に溶けますので、比例関係が成立しなくなります。また、難溶性ガスでも、圧力が高いと、(2)の気相への再放出が妨げられますので、比例関係が成立しなくなります。アンモニアや塩化水素のように、水に溶けて電離するようなガスの場合は、圧力による平衡の他に、電離平衡があるため、それぞれの平衡状態が移動するので、圧力だけの比例関係ではなくなってしまいます。
なお、ヘンリーの法則に従わない場合のpとCの関係を、ヘンリーの法則で解釈しようとすることは出来ません。
①難溶性ガスであっても、全圧及び分圧が高い場合
ヘンリーの法則は、理論式ではなく、観察によって導き出された経験則です。
溶質がヘンリーの法則に従うような溶液を理想希薄溶液といいます。つまり希薄溶液の場合にヘンリーの法則が適用でき、高濃度溶液になるとヘンリーの法則には従わなくなります。ヘンリーの法則は、もともと液側の濃度が低いところで導かれている式です。
②また比較的溶けやすいガスでも、分圧が低い場合
溶けやすいとは言え、分圧が低い場合は、吸収液中の濃度も低くなります。すなわち、ヘンリーの法則が適用できる濃度範囲に入ってくるということと考えて下さい。
- ガス吸収の条件について
-
- Q全文:ガス吸収における、分圧、温度の相関関係について
A答え:ガス吸収については、物理吸収(吸収液と化学反応を伴わない吸収)
①水に対して比較的溶けにくいガスの場合
②溶けやすいガスの場合は分圧(大気中の溶けやすいガスの圧力)が低い場合
には、次のヘンリーの法則が成り立ちます。
p=H×C
ここに、p:溶解ガスの分圧(Pa)
C:溶解ガスの液中濃度(mol/m3)
H:ヘンリー定数(Pa・m3/mol)
すなわち、ある一定の温度では、被吸収物質の圧力が上がれば吸収量は増加し下がれば減少します。
例: p=2、H=1のとき、2=1×C C=2
p=3 に上げると、 3=1×C C=3
p=1 に下げると、 1=1×C C=1
ヘンリー定数Hは、吸収液の温度が高くなると大きくなるという性質があります。したがって、吸収液の温度をあげると、Hが大きくなり、吸収液の濃度が減少(吸収量が減少)します。
例: p=2、H=1のとき、2=1×C C=2
p=2、吸収液の温度上昇 H=2に大きくなったとすると、2=2×C C=1
p=2、吸収液の温度下降 H=0.5に小さくなったとすると、2=0.5×C C=4
- 圧力損失について
-
- Q全文:圧力損失の意味を詳しく知りたい。
A答え:圧力損失とは、気体や液体が装置(例えば、スクラバーや充填塔など)や配管などの中を通る際に、装置や配管などの壁面との摩擦や装置の中の充填物などとの摩擦などにより失う圧力(エネルギー)のことです。装置や配管などの中を気体や液体を流すためには、この圧力損失以上の圧力(力)を気体や液体に加えてやる必要があります。圧力損失以上の力を加えてやらないと、気体や液体は装置や配管の中を流れません。 装置や配管の圧力損失は、下の式のように入口と出口の全圧の差で定義され(求められ)ます。圧力損失=入口での全圧-出口での全圧
例えば、装置や配管の入口側で10の圧力をかけても、装置や配管の中での圧力損失が3あれば、出口側で気体や液体が噴き出す圧力は7(10-3=7)に減少します。 すなわち、気体や液体が装置や配管の中を通過するときは、必ず圧力損失がありますので、配管の入口である大きさの圧力をかけていても、出口側では必ずこれより低い圧力になります。気体や液体の圧力が低くなるので、圧力損失と言います。
Lesson4 気体状有害物質の排ガス中のふっ化水素化合物の分析方法
- 定量範囲と適用濃度範囲の定義
-
- Q全文:定量範囲と適用濃度範囲の定義について知りたい。
A答え:種々の物質、例えばふっ素化合物の濃度を測定する方法(これを『定量方法』といいます)は一種類のみではなく複数あります。 P77 の表7-1に記載されている3種の方法は、日本工業規格(JIS)に収載されている方法です。JIS 収載の方法は個人差等の誤差が少ないあるいは制御しやすく、もちろん正確な値が得られる方法が収載されています。複数の分析方法は各々全く操作方法が異なり、検出方法も異なりますから当然分析できる濃度範囲は異なります。これを『定量範囲』といいます。定量範囲より低濃度の場合、物質の有無を検出できなかったり正確な濃度を決定できません。逆に定量範囲よりも高濃度な対象に対しては正確な濃度の決定が困難(これを飽和現象と呼びます)になります。
『適用濃度範囲』とは分析対象物質の濃度が適用濃度範囲内であれば、その定量方法で濃度を決定できることを示しています。
したがって、『定量範囲』と『適用濃度範囲』は基本的に同じことを表しています。しかし、あえて相違点を挙げるならば以下のようになります。
定量範囲:濃度測定対象物質を正確に定量できる濃度範囲を「測定者、測定法」側から記述したものといえます。
適用濃度範囲:濃度測定対象物質を正確に定量できる濃度範囲を「対象物質、被測定試料」側から記述したものといえます。
第4章 有害物質の測定
Lesson7 排ガス中のふっ化水素化合物の分析方法
- イオン調製用緩衝液について
-
- Q全文:イオン調製用緩衝液とはどういうものか?詳しく知りたい。
A答え:イオン強度調製用緩衝液にはイオン強度調製用緩衝液(I)と(II)があります。これらは濃度の極端に異なるイオン強度調製用緩衝液に対応します。
イオン強度調製用緩衝液(I)は塩化ナトリウム58g、くえん酸三ナトリウム二水和物1.2g、酢酸50mLを水約500mLに溶かし、水酸化ナトリウム(5mol/L)を加えてpH5.2に調整した後、水を加えて1Lとします。一方イオン強度調製用緩衝液(II)は塩化ナトリウム58g、くえん酸三ナトリウム二水和物11.4g、酢酸50mLを水約500mLに溶かし、水酸化ナトリウム(5mol/L)を加えてpH5.2に調整した後、水を加えて1Lとします。“イオン濃度調整用緩衝液”とは試料のイオン濃度を一定にし、イオン電極での電圧測定を安定化させるためのものを言います。
- イオン電極法によるふっ素イオン濃度の測定法について
-
- Q全文:イオン電極法によるふっ素イオン濃度の測定方法について詳しく知りたい。
A答え:イオン電極法によるふっ素イオン濃度の測定法の概要を示します。
①分析用試料溶液にイオン強度調製用緩衝液を加え、ふっ化物イオン電極を用いて電位を測定し、あらかじめ作成しておいた検量線からふっ化物イオン濃度を測定する。
②ただし、分析用試料溶液中に Fe3+やAl3+が含まれる場合は、これらがふっ化物イオン濃度測定を妨害するため、必要ならば水蒸気蒸留を行い、その留出液について定量操作を行う。
・蒸留操作(正確には水蒸気蒸留操作):水蒸気蒸留を行うこと、水蒸気蒸留はふっ化物イオンの妨害となるFe3+ や Al3+ を除去するために行う。
・留出液:水蒸気蒸留や蒸留を行って、蒸留されて出てくる液。
・定量操作:今の場合、ふっ化物イオンの量を正確に分析測定すること。具体的には ① の操作。
③ 分析用試料液中のFe3+やAl3+がふっ化物イオンの測定を妨害するか否かは次の操作で判定する。
・ふっ化物イオン(F-)が2ppm以上ある分析用試料溶液を2種準備する。
・各々に濃度が極端に異なるイオン濃度調製用緩衝液を加え電位差を測定する、
・両者の差が 3mV以下の場合:Fe3+、Al3+はふっ化物イオン濃度測定の妨害とならないため、水蒸気蒸留でFe3+、Al3+ を除去することはしない。
・両者の差が 3mV以上の場合:Fe3+、Al3+がふっ化物イオン濃度測定の妨害となるため、水蒸気蒸留でFe3+、Al3+を除去した留出液を分析用試料液とする。
・3mV を境界値とするのは、JISの規定であり、多くの実験結果から導出されたものである。JIS は再現性、正確性、簡便性などを考慮し、決定されている。
水蒸気蒸留装置の装置図は以下の通りです。

- 空試験溶液とは、ランタン-アリザリンコンプレキソン吸光光度法の空試験値の扱いについて
-
- Q全文:空試験溶液とは、ランタンアリザリンコンプレキソン吸光光度法では空試験値を差し引かないのか詳しく知りたい。
A答え:ふっ素化合物等の分析を行う場合、必ず“水”、“種々の試薬”を使用しますし、“種々の容器”や“器具”を使用します。しかし、試薬などの中に分析対象(今の場合“ふっ素化合物”)が全く含まれていない保証や使用する器具が汚染されていない保証はありません。分析精度が高くなればなるほど、これは重要な問題です。このため、同一器具(全く同じ洗浄方法で洗浄した同種・同サイズの器具)を使用し、
① 液体試料の場合には試料の代わりに水などを用いて
② 気体試料の場合には排ガスを吸収させていない吸収液
(実際の試料の測定値-空試験溶液の測定値)が正確な試料の測定値であることは容易に理解していただけると思います。これが、イオン電極法、イオンクロマトグラフ法の場合です。 それでは何故“ランタンアリザリンコンプレキソン吸光光度法”の場合には空試験値を差し引かないでよいのでしょうか? それは吸光度の測定法にあります。ランタンアリザリンコンプレキソン吸光光度法では試料溶液の吸光度を測定するとき、“対照液”として、空試験溶液を使用します。この方法で測定した吸光度は試料そのものの吸光度です。すなわち、吸光光度法の場合、“実験(吸光度測定)で引き算と同じことを行っている”のです。
Lesson10 排ガス中のカドミウム及び鉛の分析方法
- 「硝酸(1+1)」とは何か?
-
- Q全文:分析において、試薬として「硝酸(1+1)」を加えるなどと表記されますが、これはどういう意味でしょうか?
A答え:硝酸は強い酸化作用を有する強酸です。しかし、この性質は「濃硝酸」と呼ばれる酸の性質であって、濃硝酸を希釈した「希硝酸」では性質は異なってきます。分析操作などでは「濃硝酸」も「希硝酸」も同じ硝酸と表現します。
このため、通常は濃硝酸か希硝酸かを明確に示す必要があります。通常は濃硝酸がどの程度含まれるかを濃度として表示します。しかし、そこまで正確に濃度を規定しない場合には「硝酸(1+1)」というような表示が使用されます。
「硝酸(1+1)」とは、「濃硝酸1容積に1容積の水を加えた」希硝酸を表します。つまり、約50%の希硝酸です。ここでは「容積」を使用しましたが、「重量」でも同じことになります。
なお、JIS K 8001の附属書JAでは、希釈溶液として「試薬名(a+b)」の表記を用いることができる試薬の品目が規定されています。たとえば、アンモニア(a+b)、塩酸(a+b)、硝酸(a+b)などが規定されています。「試薬名(a+b)」とは、水(b容量)に試薬(a容量)を加えて混合することを表しています。
- マトリックスモディファイヤーとは何か?
-
- Q全文:分析において、マトリックスモディファイヤーという用語が出てきますが、これはどういう意味や役割があるのでしょうか?
A答え:マトリックスとは、「有機、無機を問わず分析対象成分と共存する他の成分」のことです。すなわち「分析妨害成分」のことです。
数学では、「マトリックス=行列」(演算子の一種)ですが、もちろんこれとは異なります。
次にモディファイヤーですが、モディファイ(modify)とは、「修正する、変更する」などといった意味があります。
したがって、「マトリックスモディファイヤー」とは、「分析対象物質の妨害成分の影響を除去し、対象成分を高感度で測定するために加える物質」のことです。マトリックスモディファイヤーの種類や目的は種々ありますが、重金属元素の場合にはよくパラジウムが使用され、「目的元素との間で高融点化合物を作り、灰化段階で共存物質(マトリックス)を揮散させる」といわれています。