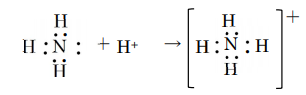- HOME
- 公害防止管理者資格取得支援
- 2023年 1月
- 通信教育QA:9水質有害物質特論
通信教育QA:9水質有害物質特論
第1章 有害物質の性質と処理
Lesson2 重金属排水の処理技術
- キレート錯体と複合錯体の違いについて
-
- Q全文:キレート錯体と複合錯体の違いについて詳しく知りたい。
A答え:
錯体(complex)もしくは錯塩(complex salt)とは、広義には、配位結合や水素結合によって形成された分子の総称です。狭義には、金属と非金属の原子が結合した構造を持つ化合物(金属錯体)を指します。錯体がcomplexと呼ばれるのは、配位子と金属イオンとの「混ざりもの」という意味からですが、研究が進むにつれ、イオンだけでなく、中性の配位子からなる場合もあることから、現在は「錯塩」よりは「錯体」という言葉を使うのが主流です
狭義の錯体は、分子の中心に金属、金属イオンが存在し、それを取り囲むように配位子が付いている化合物のことです。配位子は、非共有電子対を持ち、これにより金属と配位結合をしています。配位結合の分かりやすい例を下記に示します。アンモニウムイオンの場合、アンモニアの窒素原子Nの1つの電子対が余っており(非共有電子対)、この電子を使って水素イオンと共有結合を作ることが出来ます。普通の共有結合では、電子を1つずつ出し合って結合しますが、このように片方の原子から2つとも電子が供給されて結果的に共有結合が形成されるものを「配位結合」と呼びます。電子がどのよう供給されたかの違いだけで、出来上がるのは共有結合ですから、かなりしっかりした結合になります。
アンモニア 水素イオン アンモニウムイオン
図1 配位結合の例
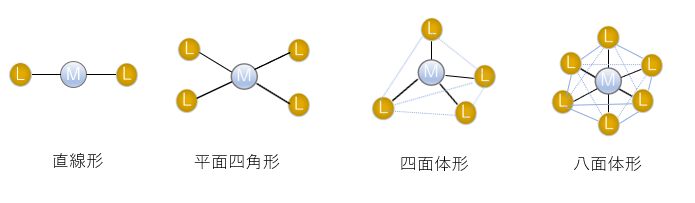
錯体の構造の代表的なものは、直線型(配位数2)、四面体型(配位数4)、平面四角型(配位数4)、八面体型(配位数6)が挙げられます。図2 錯体の構造の例
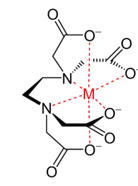
錯体のうち、キレート環と呼ばれる1個の分子またはイオン内の2個以上の配位原子が、金属原子(イオン)をはさむように配位してできた環構造を持つ錯体を特にキレート錯体と呼び、ギリシア語のカニのハサミがその由来になっています。キレート錯体の例として、EDTA(エチレンジアミン四酢酸)を示します。この場合、赤い点線の配位結合が6つありますから、かなりしっかりした結合となります。
図3 キレート錯体の例(EDTA)
また2種以上の錯体が複合したものを特に複合錯体と呼ぶこともあります。
一方、会合とは同一分子間に水素結合、電荷移動結合、疎水結合などのような比較的弱い結合力がはたらき、2分子あるいはそれ以上の分子が結合して,比較的規則性のよい集合体を形成することを言いそのうちイオンが会合している場合を“イオン会合体”といいます。別の言い方をすれば、静電引力に基づく外圏錯体生成反応であり、広義の錯体の一種とも言えます。機構が静電気力のため、配位結合ほど結合力は強くありません。金属イオンなど、イオン性物質の分離、検出に用いられることがあります。
“錯体”とは中心となるイオンや原子(これを「中心イオン」、「中心原子」といいます)に、別種のイオン、分子、多原子イオンが結合した集合体であり、錯化合物とか配位化合物とも呼ばれます。“錯塩”も錯体と同義です。
錯体は上記のような定義ですので、多くの種類に分類され、例えば中心原子が複数ある“多核錯体”、クラスター錯体などなどの種類があります。 “キレート錯体”とはキレート環を有する錯体の総称で、単にキレートともよばれ、もちろんこれも錯体の一種です。キレート環とは1個の原子またはイオンの持つ2個以上の配位原子が金属原子または金属イオンをはさむように配位してできた環構造をいいます。
複合錯体とは明確な定義はないのですが、2種以上の錯体が複合したものです。したがって、複合錯体も、キレート錯体も錯体に含まれるものです。 - Q全文:キレート錯体と複合錯体の違いについて詳しく知りたい。
Lesson3 カドミウム・鉛排水の処理
- カドミウムや鉛の処理水中の溶解度について
-
- Q全文:カドミウムや鉛の処理水中の溶解度の計算方法について詳しく知りたい。
A答え:カドミウムの処理水を例に、計算方法、計算結果を以下に示します。
Cd(OH)2 溶解度積は3.9×10-14です。よって
[ Cd2+]・[ OH-]2=3.9×10-14(mol3/L3 ) --- (1)
[ Cd2+ ]=3.9-14/[ OH-]2 --- (2)
で [ Cd2+ ] を計算できますが、[ OH-], [ OH-]2 が不明です。[ OH-] は以下の水の溶解度積を利用して計算します。水は下式のように電離します。
H2O ⇄ H++OH–
この電離式に関しては
[ H+] [ OH-] = Kw Kw(mol2/L2 )は25℃ において 10-14です。
これは pH 理論の根幹を成すものです。
[ H+] × [ OH-] = 10-14(mol2/L2 )したがって、--- (3)
[ OH-] = 10-14/[ H+] (mol/L)--- (4)
で [ OH-] を計算することができます。そこで (2) 式に (4) を代入して
[ Cd2+ ] = 3.9×10-14× [ H+]2/( (10-14)2
= 3.9×10-14×[ H+]2/10-28 --- (5)
(5) 式を書きなおすと
[ Cd2+ ]=3.9×10-14×([ H+]2×1028)
となります。このCd の濃度単位は mol/L で、これをmg/Lに変換するためにはCdの原子量112及びgをmg に変化するための103を乗じてやる必要があります。
また、実際に濃度を計算するには [H+](水素イオン濃度) が必要ですが、これは pH であり、pHの定義式
pH=–log[ H+]から[ H+]=10–pH で求めることができます。 - Q全文:カドミウムや鉛の処理水中の溶解度の計算方法について詳しく知りたい。
- アンモニア錯イオン、シアン化錯イオンについて
-
- Q全文:アンモニア錯イオン、シアン錯イオンについて詳しく知りたい。
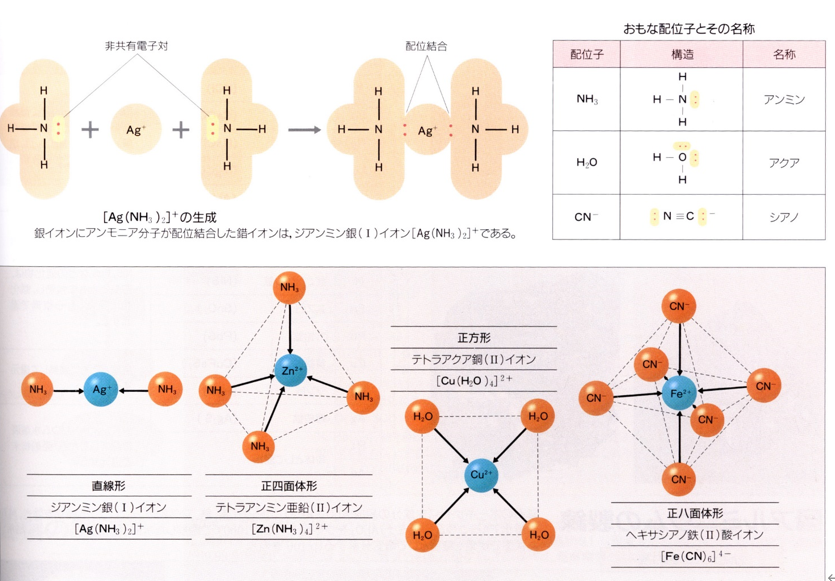
A答え:アンモニア錯体は正式には“アンミン錯体”といいます。金属や金属イオンにアンモニア(NH3)が配位したものです。金属としては、カドミウム (Cd)、コバルト (Co)、銅 (I), (II)、鉄 (Fe)、マンガン(Mn)、水銀 (Hg)、ニッケル (Ni)、白金 (Pt)、銀 (Ag)、亜鉛 (Zn) などです。例えば、銀アンミン錯体の化学式は [ Ag(NH3)2 ]+ になります。この構造は下のようになります。一方シアノ錯体は金属や金属イオンにシアンイオン(CN–)が配位したものです。金属としては、カドミウム (Cd)、銅 (I) (Cu)、鉄 (II), (III) (Fe)、水銀 (Hg)、ニッケル (Ni)、銀 (Ag)、亜鉛 (Zn) 等です。これらの構造は金属が銀の場合 [ Ag(CN–) ] – (直線型)、カドミウムの場合[Cd(CN)4]2–(正四面体型)鉄(Ⅲ)の場合 [ Fe(CN)6 ]3H2O(正八面体)です。
- Q全文:アンモニア錯イオン、シアン錯イオンについて詳しく知りたい。
Lesson4 クロム(Ⅵ)(六価クロム)排水の処理
- 酸化剤・還元剤の定義・酸化・還元について
-
- Q全文:酸化剤・還元剤の定義・酸化・還元について詳しく知りたい。
A答え:最も答えやすい「還元剤の定義」からお答えします。
還元剤とは、“相手を還元して、自分自身は酸化される物質” を言います。逆に酸化剤とは、相手を酸化して、自分自身は還元される物質を言います。
酸化と還元は全く反対の反応です。また、酸化と還元反応が別々に起こることはなく、必ず酸化反応と還元反応が同時に起きています。まず酸化反応とは何か、還元反応とは何かを説明します。この時、反応を次の見方で見ていくことにします。
反応の見方 酸化の定義 還元の定義 酸素との反応 酸素と結合すること 酸素を放出すること 水素との反応 水素を放出・遊離すること 水素と結合すること 電子の授受による見方 電子を放出(失う)こと 電子を受容すること(取り入れ) 酸化数の増減による見方 酸化数の増加 酸化数の減少 酸化数の数え方は以下の約束で行います。
①単体中の原子の酸化数は0 とする。
②化合物中の“水素原子の酸化数 = +1”とする。例外:金属の水素化物では“– 1”
③化合物中の“酸素原子の酸化数 = – 2”とする。例外:過酸化物では“– 1”
④化合物を構成する原子の酸化数の総和は 0 とする。
⑤単原子イオンを構成する原子の酸化数はそのイオンの電荷の符号、価数に等しい。
⑥多原子イオンを構成する原子の酸化数の総和は、そのイオンの電荷の符号、価数に等しい。 - Q全文:酸化剤・還元剤の定義・酸化・還元について詳しく知りたい。
- ORP変化が緩やかになると注入量が多くなる理由は?
-
- Q全文:ORP変化が緩やかになると注入量が多くなる理由を知りたい。
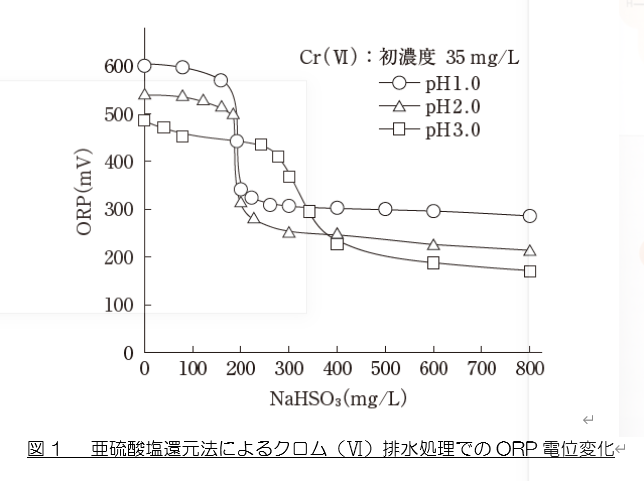
① グラフの縦軸は“ORP(酸化還元電位)”であり、クロムの還元程度を示します。すなわち、“クロム(Ⅵ)→ クロム(Ⅲ)への変化量(還元された量)”です。
② グラフの横軸は“還元剤 NaHSO3 の濃度”ですから、“NaHSO3 の注入量”とも言えます。
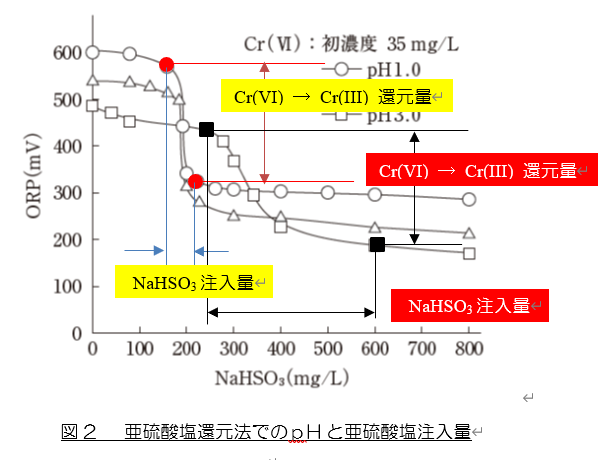
③ pH 1.0の場合(ORP変化が急激な場合)の、Cr(VI) → Cr(III) の変化は、図2の“●” で表すことができます(この場合のORP電位差は約250mV)。この時のNaHSO3 の濃度差は約70mg/L(150mg/Lと220mg/L)です。NaHSO3 の濃度差は“NaHSO3 の注入量”です。
④ 一方、pH 3.0の場合(ORP変化が緩やかな場合)の、Cr(VI) → Cr(III) の変化は、図2の“■”です(この場合のORP電位差は約250mV)。この時のNaHSO3 の濃度差は実に約350mg/L(250mg/Lと600mg/L)です。NaHSO3 の濃度差は“NaHSO3 の注入量”ですから、ORP変化が緩やかな場合には亜硫酸ナトリウムの注入量が多くなることが分かります。
- Q全文:ORP変化が緩やかになると注入量が多くなる理由を知りたい。
Lesson5 水銀排水の処理
- 水銀を硫化物凝集沈殿法で処理する場合の硫化ナトリウムの添加量について教えてください。
-
- Q全文:水銀を硫化物凝集沈殿法で処理する場合の硫化ナトリウムの添加量について教えてください。
A答え:硫化ナトリウムを加え過ぎると水銀は錯イオンを作って再溶解します。従って、入れすぎないことが肝要です。どのくらいまで過剰にいれてよいかという一般的な基準はありません。排水処理を行う場合、前もってジャーテストにより処理ができるか否か、どの程度試薬を加えるとよいかを確認して処理条件を決めます。これは、既設の排水処理設備に新たに違う排水を導入する場合も同様で、あらかじめジャーテストで処理の可否、処理流量などを確認します。
濃度変動があると、それに応じて試薬の添加量も変えなければなりません。実際の設備は処理量が大きいので、試薬の注入量を変えても全体が同じ条件になるのに時間がかかるので、処理が不十分になる時間帯ができてしまします。
従って、処理条件は一定にして処理を行うことが安定した排水処理には必要で、そのためには原水(処理前の排水)の品質をできるだけ一定にするため、原水の大きなバッファータンクを設けて水質の平準化が行われています。何日分のバッファーがあればよいかは、排水の変動により判断されます。
硫化ナトリウムの添加量の目安については、平準化した排水の水質にてジャーテストで添加量を確認するという回答になります。 - Q全文:水銀を硫化物凝集沈殿法で処理する場合の硫化ナトリウムの添加量について教えてください。
- 水銀排水の処理に使用したキレート樹脂や活性炭は再生できないのですか?
-
- Q全文:水銀排水の処理に使用したキレート樹脂や活性炭は再生できないのですか?
活性炭の水銀吸着量は比較的大きく、排水処理として有効であるが、脱着は一般的に焼却炉で600~800℃に加熱され、水銀は金属蒸気として回収するので、再生使用は難しくなります。(何らかの方法で活性炭から遊離させたとして、次のこの遊離した水銀をどう回収するかを考えると、同じことの繰り返しになってしまいます。) - Q全文:水銀排水の処理に使用したキレート樹脂や活性炭は再生できないのですか?
- 水銀、クロムの吸着に対する活性炭の有効性とは?
-
- Q全文:水銀、クロムの吸着に対する活性炭の有効性とは?
なお、クロムイオンはイオン交換樹脂への選択性が高いため、強塩基性陰イオン交換樹脂に通水すれば、ほぼ完全に除去されます。しかし、再生廃液の処理が必要で、イオン交換樹脂のコスト、再生剤の費用などを考慮するとコスト高になり、大規模の排水処理には適さないのです。 - Q全文:水銀、クロムの吸着に対する活性炭の有効性とは?
Lesson7 ほう素排水、ふっ素排水の処理
- フルオロほう酸の凝集処理について教えてください。
-
- Q全文:フルオロほう酸の凝集処理について教えてください。
- Q全文:フルオロほう酸の凝集処理について教えてください。
Lesson8 シアン排水の処理
- オゾン酸化のおける銅の役割とは?
-
- Q全文:オゾン酸化のおける銅の役割について教えてください。
- Q全文:オゾン酸化のおける銅の役割について教えてください。
Lesson9 その他の有害物質の排水処理
- 亜硝酸態窒素及び硝酸態窒素の窒素換算について
-
- Q全文:水亜硝酸態窒素及び硝酸態窒素の窒素換算について教えてください。
アンモニア性窒素と亜硝酸性窒素及び硝酸性窒素では毒性に差があるので、(亜硝酸性窒素及び硝酸性窒素は毒性がアンモニア性窒素より毒性が強い)アンモニア性窒素には0.4をかけています。
なお環境基準の「硝酸性窒素及び亜硝酸性窒素」について、備考で、硝酸イオンの換算係数を0.2259、亜硝酸イオンの換算係数を0.3045としているのは次の理由です。
原子量は N=14.01、H=1.008、O=16.00ですから
NO3-(硝酸イオン) の分子量 14.01+16.00×3=62.01
N(窒素)の割合 14.01÷62.01=0.2259
NO2-(亜硝酸イオン) の分子量 14.01+16.00×2=46.01
N(窒素)の割合 14.01÷46.01=0.3045 - Q全文:水亜硝酸態窒素及び硝酸態窒素の窒素換算について教えてください。
- 1,4-ジオキサンの処理方法とは?
-
- Q全文:1,4-ジオキサンの処理方法とは?
従って、ジオキサンを含む排水の場合、焼却炉或いは燃焼炉中に吹き込んで燃焼させる方法が最も確実です。※この方法は、他に有機物の処理方法としても適用できます。 - Q全文:1,4-ジオキサンの処理方法とは?